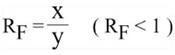LES PROPRIÉTÉS ÉTUDIÉES
1
Propriétés
chimiques
1.1
Composition
chimique
La
composition chimique d’une espèce donnée est la répartition des atomes qui
composent une molécule de cette espèce. On peut alors parler :
-
de la composition qualitative : celle-ci
permet de connaître les composés ioniques et/ou les atome qui forment
l’espèce.
-
de la composition quantitative : cette
dernière permet de connaîtes les proportions de chaque atomes/composés
ioniques par rapport aux autres. On exprime généralement cette proportion
en pourcentage. La somme des pourcentages de chaque composant est, en toute
logique, égale à 100%
-
1.2
Solubilité
La
solubilité d’une espèce chimique correspond à la quantité maximale de cette
espèce chimique que l’on peut dissoudre par unité de volume de solvant.
L’unité du système international (S.I.) utilisée pour exprimer cette
grandeur est la mol.m-3. Ainsi, on exprime le nombre de mole(s) maximale que l’on
pourra dissoudre dans un mètre cube de solvant. Cependant, dans
l’utilisation courante, l’unité utilisée est généralement le g.L-1 . Le solvant
le plus souvent utilisé est l’eau. En effet, c’est dans l’eau que les
composés ioniques (polaires) se dissocient le mieux. Quant au soluté
(l’espèce dissoute), il peut être sous forme de liquide (exemple :
dissolution de l’air dans l’eau), de gaz ou de solide. Dans la
majorité des cas, une espèce pourra voir sa solubilité augmenter avec la
hausse de température.
1.3
Configuration
spatiale
La
configuration spatiale des molécules permet de connaître la géométrie
d'une molécule. Afin de se faire une idée de la géométrie d'une
molécule, on peut utiliser différents modèles de représentations qui
spécifient la géométrie de la molécule suivant sa forme (linéaire,
triangulaire, pyramidale, tétraédrique principalement) et ses différents
plans. On utilise principalement au lycée:
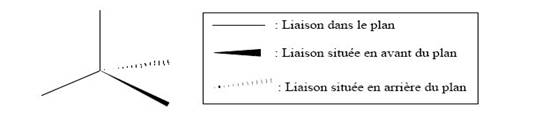
La
représentation de Cram.
Contrairement
à la représentation de Lewis où toutes les liaisons sont représentées de
manières similaires les unes par rapport aux autres (dans un même plan) la
représentation de Cram différencie les liaisons selon leurs plans selon
leurs placements dans l'espace :
La
configuration spatiale des molécules est d’autant plus importante qu’elle
joue un rôle primordial dans l’interprétation des odeurs des différents
arômes, par le cerveau.
En effet,
l’olfaction est la fonction sensorielle qui correspond à la perception des
substances odorantes. L’odeur est due à l’interaction entre les molécules
de ces substances odorantes et des protéines situées dans la membrane des
cils des cellules réceptrices. Ces cellules sont des neurones constitués
d’un corps cellulaire situé dans la muqueuse et d’un axone (= long
prolongement fibreux d’un neurone émergeant du corps cellulaire, qui
conduit l’influx nerveux. Il permet donc la transmission des messages tels
que la douleur sous la forme de signaux de nature électrique), communiquant
avec le bulbe olfactif (partie du cerveau qui interprète les odeurs). Pour
qu’une substance soit odorante, il faut que les cellules réceptrices
envoient un signal vers le cerveau, et il faut donc qu'un nombre suffisant
de molécules arrive au contact des protéines. Ces dernières doivent être
nombreuses et variées pour reconnaître un grand nombre de substances.
Les
molécules odorantes (les ligands) peuvent arriver directement par diffusion
dans le mucus, mais peuvent arriver aussi par des protéines de transports
qui permettent aux molécules hydrophobes de pénétrer aussi dans le mucus
(comme le font la majorité des molécules).
Les
molécules odorantes peuvent donc atteindre puis se fixer sur les récepteurs
des cellules olfactives par complémentarité de forme. Ainsi les molécules
ayant des configurations spatiales différentes, elles activent des
récepteurs sensoriels différents. Un message nerveux sensitif est émis
grâce à l’axone des neurones jusqu’à vers le bulbe olfactif qui interprète
alors ce message par une odeur.
1.4
Constante
d’acidité
La
constante d’acidité entre en jeu lors de la dissolution d’un acide dans un
solvant particulier : l’eau. A chaque acide correspond une base.
Ainsi, il existe des couples acide-base. Un acide est dit
« faible » lorsque son ionisation en solution aqueuse est
partielle, et donc réversible. Soit un acide faible HA et sa base conjuguée
A- . On a alors : HA + H2O --> H3O+ + A- Plus un
acide est fort, plus son ionisation dans l’eau est forte, plus sa
dissociation dans l’eau est forte, et plus sa constante d’acidité est
élevée. Ainsi, une espèce dont la constante d'acidité est forte est un
acide dont le pH est très faible. La constante d’acidité, nommée pKA est
donnée par la formule suivante :
(Avec A- la forme basique d'un couple et HA sa forme basique.)

1.5
Rapport
frontal
Le rapport
frontal entre en compte lors de la réalisation d’une chromatographie. La
chromatographie permet de séparer et d’analyser les constituants d’un mélange,
d’une espèce en le faisant circuler à travers un milieu fixe inerte (plaque
d’alumine, de silice…) à l’aide d’un solvant mobile (gaz, ou plus
couramment liquide) qui l’entraîne. Chaque constituant adopte une vitesse
de migration qui lui est propre en fonction de sa solubilité dans la phase
mobile et de son affinité pour la phase fixe qui tend à le retenir. On
cherche donc à savoir le rapport entre la distance parcourue par l'espèce
et la distance parcourue par le solvant. C'est pourquoi, selon le solvant
utilisé, le rapport frontal diffère. Il est donc nécessaire de citer le
solvant utilisé lorsque l'on donne un Rapport Frontal. La distance que
parcourt chaque constituant de l’espèce analysée en un laps de temps donné
se traduit par le rapport frontal (RF).
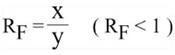
1.6
Réactivité
La
réactivité d’une espèce chimique est sa capacité à réagir avec d’autres espèces
chimiques. Comparer la réactivité de deux espèces chimiques, c’est vérifier
qu’elles réagissent de la même manière avec les mêmes produits. On place
donc en contact deux espèces chimiques à comparer avec les mêmes produits,
et cela séparément.
Selon les produits utilisés pour
faire le test, différentes méthodes peuvent être utilisées pour savoir si
les espèces ont réagi de la même façon (test sous la lampe UV, test avec un
indicateur coloré...).
Cependant,
ce test ne permet pas de faire une généralité. En effet, il est incohérent
de dire que deux espèces chimiques sont identiques si elles réagissent
similairement avec un produit. En effet, nous ne savons pas le comportement
qu'elles auraient adopté en présence d'autres espèces chimiques, et il est
évidemment impossible de tester toutes les espèces chimiques les unes avec
les autres... ce test peut donc servir de contre-exemple, et démontrer que
deux espèces chimiques différentes n'ont pas la même réactivité face à la
même espèce chimique. Mais comparer deux espèces chimiques avec un produit
ne permettra pas de dire qu’elles réagiront toujours de la même manière
avec d'autres produits...
2 Les propriétés
physiques…